医院伦理委员会负责审查由医学专业技术人员任主要研究者的涉及人的临床研究方案和科研项目设计方案。本伦理委员会只接受研究者递交的方案。
为使您递交的研究方案尽快进入审查程序,请在递交申请时,按照申请审查的类别备妥以下文件,如果有任何疑问请致电021-64385700-1318或发邮件至lhtcmirb@sina.cn询问。
研究方案的初次审查时,先将电子版材料发送至邮箱lhtcmirb@sina.cn,形式审查后会以邮件形式通知递交纸质版文件,纸质版文件应递交12份,2份需盖章(一份由伦理委员会存档,一份交给GCP存档)。
附件:
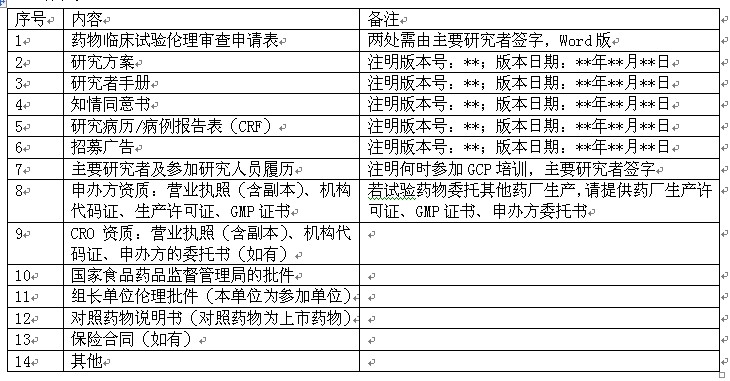
1. 药物临床试验伦理审查申请表
2. 研究方案
3. 研究者手册
4. 知情同意书设计规范
5. 招募广告
6. 主要研究者简历
7. 参加研究人员履历
